modelo atomico de aristoteles dibujo
Avanzando hacia la derecha, estamos con el bloque d, aparece el bloque p y por último el bloque f, el último de los cuales se esconde bajo el cuerpo primordial de la Tabla. Este ordenamiento de los bloques de izquierda a derecha no es lo más natural o como podrían esperarse, puesto que en todos y cada capa la distancia desde el núcleo prosigue el orden. Tomando una situación realista puede parecer inconcebible que al cuestionar a algunos químicos académicos sobre si el elemento hidrógeno forma parte al conjunto 1 o a al grupo 17 (halógenos) ciertos respondan no es importante. La tabla periódica es un concepto aparentemente simple o es como suele verse. O sea lo que invita a los científicos apasionados a evaluar su talento en el avance de nuevas versiones que con frecuencia afirman tener características superiores que todos y cada uno de los sistemas periódicos previamente publicados.
Leer mas sobre organigrama de una empresa aqui.
Inconvenientes De Física Y Química 3º Eso
Esta vez no vas a factorizar, trabajarás con la expresión de forma habitual para demostrarles que se obtiene solución de cualquier manera, trabajarás con las expresiones que representan la base y la altura. Para la base del rectángulo, conoces prácticamente lo mismo; marcarás la medida de 90, que es lo que mide el lado de la vivienda. Puedes observar que tienes una medida de la parte superior, que mide 90 metros, también puedes observar que tienes el área de m2, y la manera en la que está dividido el terreno. Como 18 no tiene raíz precisa, lo descompones en 2 componentes, para este caso, lo descompones en 9 y 2, ya que 9 por 2 da como resultado 18.
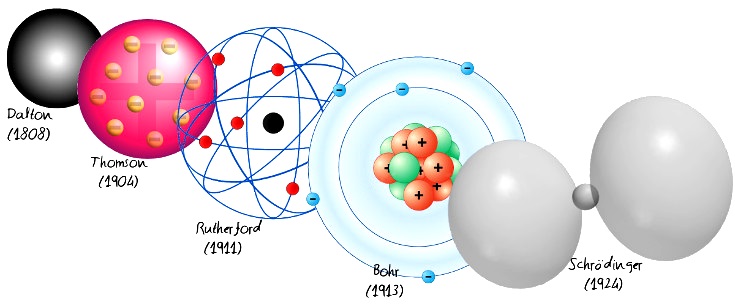
Prout no había esclarecido la razón de las evasiones a la secuencia característica, pero sugirió que la causa radicaba en visto que el peso de esos átomos aberrantes no habían sido aún ciertos con precisión. La hipótesis de Prout, como llegó a ser famosa, fue fructífera ya que permitió a otros hacer mediciones de los pesos atómicos con mayor exactitud en lugar de ponerse un límite a mostrar su acompañamiento o desaprobación. Consiguientemente el refinamiento de pesos atómicos más precisos jugaría un papel primordial en el hallazgo y evolución de la Tabla periódica.
La Importancia De La Observación En La Ciencia
La explicación estricta de la ocupación de los orbitales por los electrones radicó en que estos fueron llenados en estricto orden secuencial. A pesar de que los orbitales electrónicos fuesen llenados de manera secuencial, esto perdía credibilidad desde el elemento número 19, el potasio. Las configuraciones electrónicas se construyen empezando con orbital 1s que tienen la posibilidad de contener dos electrones, pasando al orbital 2s que del mismo modo se ocupa por dos electrones. Entonces se muestran los orbitales 2p que en conjunto poseen seis electrones y de esta forma sucesivamente. El proceso sigue de forma predecible hasta el elemento número 18 o argón cuya configuración electrónica es.
Estas en una época sin igual, que ayuda a cada persona a expresarse de una forma íntima o tumultuaria. Las redes puedes utilizarlas para poder ver una película, visitar museos extranjeros, oír la novedosa canción de tu cantante favorita, ver cómo millones de personas efectúan una misma coreografía para expresarse o tomar una clase de manera virtual para estudiar algo nuevo. Anda en el espacio, creando y formando un círculo, al llegar al punto de comienzo donde se dio el paso inicial, da un giro hacia la izquierda, dando recorridos amplios a lo largo del espacio escénico, creando y destacando a su vez el concepto del tiempo y del espacio. El correr del tiempo en el cuerpo también lo puedes observar en las cicatrices, ya que esas a veces te cuentan una historia, en ocasiones de algo muy asombroso que hiciste y no te salió tan bien, tal vez de algo sorprendente o incluso de algo que te da tristeza.
modelo atomico de aristoteles dibujo
undefined
Leer mas sobre listado de iglesias en mexico aqui.
Muestran un electrón en la capa de valencia (configuración ns1, siendo n el número del periodo del elemento), con lo que tienden ceder dicho electrón, convirtiéndose en iones positivos. Los elementos a los que les faltan solamente uno o 2 electrones para conseguir la configuración del siguiente gas noble en la tabla, tienen mucha tendencia a captar electrones en sus links con otros átomos. Generalmente, los no metales son elementos muy electronegativos, y tienden a captar electrones, dando rincón a iones negativos. Para un mismo elemento existen varios isótopos estables en la naturaleza, la masa atómica de un elemento es la media de sus isótopos estables, ponderada según su abundancia en la naturaleza. Por ejemplo, todos los átomos de hidrógeno tienen 1 protón en su núcleo, todos y cada uno de los átomos de oxígeno tienen 8 protones en su núcleo, todos y cada uno de los átomos de hierro tienen 26 protones en su núcleo, etc. En condiciones normales los átomos son eléctricamente neutros, gracias a que tienen igual número de protones que de electrones.
undefined
32) Indica tres características de los elementos metálicos, y tres de los elementos no metálicos. 31 26) El níquel se encuentra en la naturaleza en forma de los próximos isótopos. El helio, el neón, el argón y kriptón son los primeros elementos de esta familia.
- Disminuye al avanzar en un periodo por el hecho de que el factor determinante es el aumento de la carga efectiva del núcleo que ejercita una mayor atracción sobre la corteza electrónica.
Por lo tanto, la Tabla periódica ha servido como campo de pruebas para las teorías de la física atómica y por muchos puntos tempranos de la teoría cuántica y de la mecánica cuántica más adelante. La situación que existe hoy es esa química, y en particular la Tabla periódica es considerada explicada totalmente por la mecánica cuántica. ¿de qué manera se equipararon sus intentos de explotar la naturaleza electrón, los de Bohr con otros físicos cuánticos? En él asumió que los electrones se generan en las esquinas de un cubo y que a medida que se avanza por medio de la tabla periódica, un elemento a la vez, se agrega un electrón mucho más en entre las esquinas. Finalmente el hallazgo de los isótopos clarificó aún más la aparición de inversiones de elementos emparejados, como la situacion del telurio y yodo en la representación de Mendeleev. El telurio tiene un peso atómico mayor que el yodo, si bien lo antecede en la Tabla periódica, porque la media ponderada de todos y cada uno de los isótopos del telurio tiene valores más altos que la media ponderada de los isótopos del yodo.
undefined
Mendeleev después describió esta actividad entre sus colegas como un obsesionamiento con las tríadas, que él percibía había retrasado el descubrimiento de un Sistema periódico maduro. No obstante, el sistema postulado por Gmelin no puede ser considerado como un Sistema periódico ya que no exhibe la reiteración periódica de las propiedades de los elementos. Esta fue la primera ocasión en que una Tabla de elementos sentó las bases de cara al desarrollo de un libro terminado de química. Los pesos atómicos medidos con mayor precisión sugerían que, en realidad los átomos de los elementos no eran múltiplos exactos del átomo de hidrógeno. Sin embargo, la hipótesis de Prout fue destinada a hacer una reaparición más adelante en la historia, aunque se presentaría en una forma modificada. Pero no todos los pesos atómicos publicados correspondían a múltiplos exactos del peso del átomo de hidrógeno.
Lea mas sobre desarrollosdesoftware aqui.