Contenido
aportaciones al modelo atomico de sommerfeld
La masa es una propiedad del cuerpo, mientras que el peso es la fuerza ejercida sobre el cuerpo a causa de la gravedad. La curiosidad en relación al tamaño y masa del átomo atrajo a cientos y cientos de científicos durante un largo intérvalo de tiempo en el que la carencia de instrumentos y técnicas apropiadas impidió obtener respuestas satisfactorias. Posteriormente se diseñaron varios ensayos ingeniosos para saber el tamaño y masa de los distintos átomos. Un átomo es tan pequeño que una sola gota de agua tiene dentro mucho más de mil trillones de átomos. Ciertas partículas elementales se mezclan para formar átomos, que paralelamente se combinan para formar moléculas.
Llamó a su descubrimiento “procedimiento de las fluxiones” y de él derivan todo el cálculo diferencial y también integral. No obstante, Gottfried Leibniz, matemático coetáneo a Newton, lo logró simultáneamente con una notación mucho más simple, con lo que fue la que se impuso y la que se utiliza hoy en dia. Científico, físico, filósofo, alquimista y matemático inglés, creador de los Philosophiae Naturalis Comienza Mathematica, más conocidos como los Comienza, donde describió la ley de gravitación universal y estableció las bases de la Mecánica Clásica a través de las leyes que llevan su nombre. Fue, asimismo, entre los hombres mucho más respetados por la sociedad inglesa en sus tiempos y quizá el científico más religioso que se haya mencionado, hábito que muchos ignoran.
La Física Cuántica Para Principiantes
Leer mas sobre libros contestados aqui.
Nadie había deducido el orden de los orbitales intermedios de relleno desde los principios de la mecánica cuántica. Lo que de ninguna manera significa que el orden de llenado de los orbitales atómicos por los electrones es en algún sentido intrínsecamente irreducible a la física cuántica. Bohr entonces, amplió su modelo para contemplar cualquier átomo de un número mayor de electrones en vez de limitarse al átomo de hidrógeno. Él también mostró enorme interés en detallar la forma en que los electrones estaban distribuidos en cualquier átomo especial.
Modelo De Dalton Es El Primer Modelo Atómico Con Bases Científicas ..
Leer mas sobre listado de iglesias aqui.
- La periodicidad química puede no parecer una ley, tal como lo son la mayoría de las leyes en la física.
- El físico danés Thomson pensó que el átomo se encontraba compuesto por una esfera de carga positiva donde se incrustaban los electrones como pasas en un pastel.
Su trabajo ayudó a impulsar el término de que los electrones se encuentran en capas y que los de la última cubierta determinan las propiedades químicas de un átomo. Gracias al comienzo de exclusión de Pauli es posible comprender el lugar que los diversos elementos químicos llenan en la Tabla Periódica de los Elementos. Átomos con configuraciones electrónicas semejantes tienen características químicas similares. La conclusión aparentemente la periodicidad química es un fenómeno asombrosamente robusto.
aportaciones al modelo atomico de sommerfeld
undefined
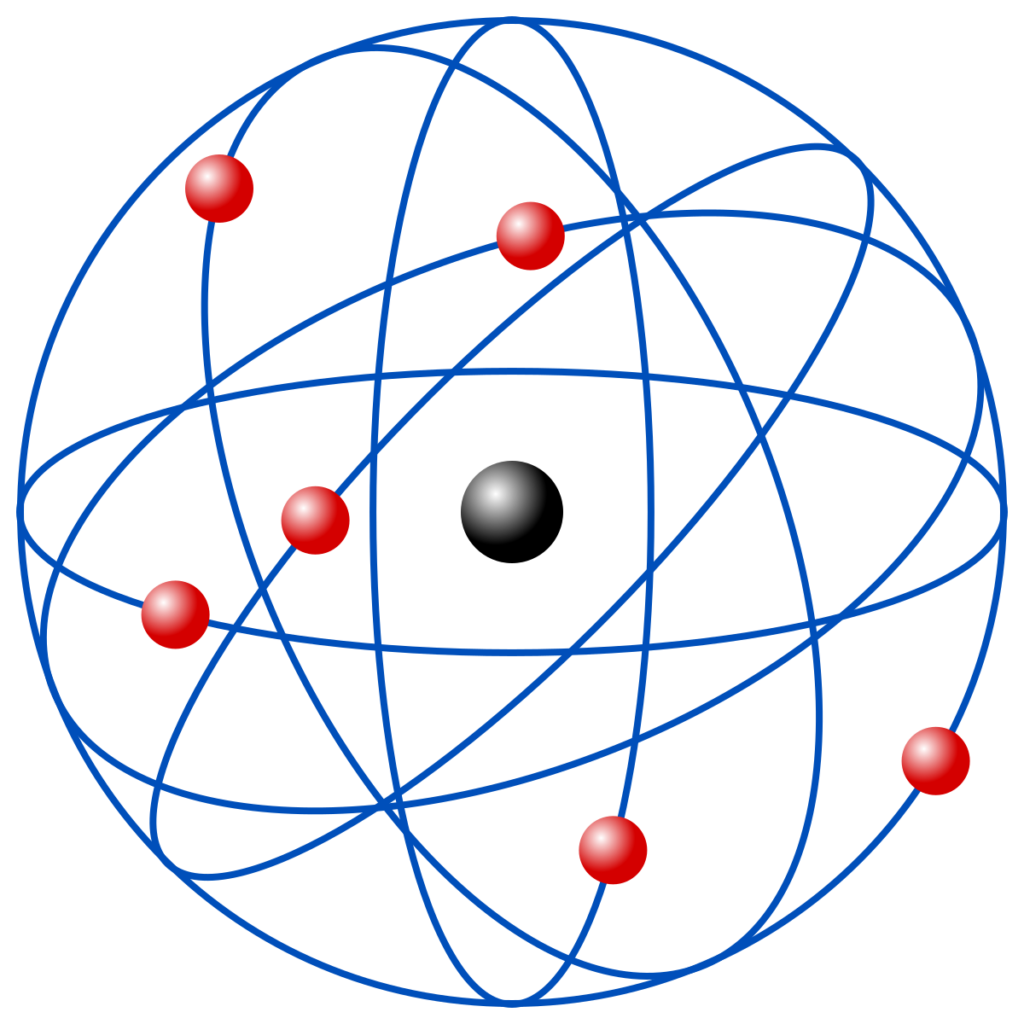
También se halló que algunas de las líneas del fantasma en las ImagLec3 espectrales del hidrógeno como ion se disolvían en inesperados pares de líneas. Arnold Sommerfeld sugirió que el núcleo podría posicionarse en uno de los extremos de la elipse en vez de en el corazón de un átomo circular. Sus cálculos demostraron que había que ingresar subcapas en las capas primordiales de Bohr de los electrones.
Está cargado de forma positiva pues un electrón cargado de manera negativa se eliminó del átomo. Los 91 electrones restantes fueron superados en número por los 92 protones cargados positivamente, lo que resultó en una carga de +1. El número atómico que vemos en la parte superior izquierda es la proporción de protones en un átomo de un factor.
undefined
Este problema guarda relación directa con lo que pasa en zonas de alta presión en donde existe un sinnúmero de hidrógeno, como por poner un ejemplo dentro de las estrellas. Pero existe otra razón por la que el arreglo desarrollado por Jensen es el mejor y esto no es dependiente de cualquier lealtad a las tríadas del número atómico. Si tenemos en cuenta la Tabla periódica de formato largo el intento de integrar al lutecio y laurencio o lantano y actinio en el grupo 3, solo la primera propuesta tiene sentido porque es el resultado de una secuencia continuamente creciente de números atómicos. Por el contrario la incorporación del lantano y actinio en el conjunto 3 en una Tabla periódica de formato medio largo resulta en 2 anomalías muy evidentes en concepto de la secuencia de números atómicos crecientes. Desde 1997, fueron publicadas varias demandas para la síntesis de los elementos del 113 al 118. Esta situación se entiende dado que los núcleos con un número impar de protones son invariablemente más inestables que aquellos con un número par de protones.
@YoKeenhy aportaciones al modelo atomico de democrito dalton thomson rutherford bohr sommerfeld chadwick schrodinger dirac-jordan
— Sr. Doctor Profesor (@SoyXiico) July 22, 2012
Lea mas sobre software-recupero-crediti aqui.
undefined
Ésta fue presentada por Isaac Newton en su libro Philosophiae Naturales Comienza Matemática, publicado en 1687, donde establece por primera vez una relación cuantitativa (deducida experimentalmente de la observación) de la fuerza con que se atraen 2 elementos con masa. De esta manera, Newton dedujo que la fuerza con que se atraen dos cuerpos de diferente masa únicamente es dependiente del valor de sus masas y del cuadrado de la distancia que los divide. Explicar la composición de la luz ha sido uno de los enormes enigmas de la ciencia a lo largo de la historia. En la antigua Grecia se creía que la luz estaba formada de pequeñas partículas que eran las que constituían los rayos lumínicos. Newton apoya esta iniciativa y postula que la luz está constituida por corpúsculos lanzados a gran velocidad por los cuerpos emisores de luz y que no son ondas, como defendían sus contemporáneos. Desarrolla un estudio detallado y exacto de los fenómenos de reflexión, refracción y dispersión de la luz.
Estos eran algo confusos y complicados en su interpretación lo que dificultaba significativamente fuesen plasmados en la reproducción de libros y productos. El uso moderno de los símbolos que representan a los elementos fue introducido por el químico Jöns Jacob Berzelius en 1813. Los símbolos que se emplean para representar cada elemento en la Tabla periódica asimismo tienen una historia digna de nuestro interés. En los tiempos de la alquimia, los símbolos de los elementos de forma frecuente, coincidieron con los de los planetas desde el momento en que fueron nombrados o asociados a estos. El elemento mercurio, compartió el mismo símbolo que el del Mercurio mundo más interno del sistema solar, el cobre fue asociado con el planeta Venus, juntos elemento y planeta compartieron exactamente el mismo símbolo.