en que consiste el modelo atomico de sommerfeld
Los experimentos de Moseley permitieron demostrar una secuencia a la perfección regular en el ordenamiento de los elementos en la Tabla periódica, adoptando una unidad, el número atómico. Mendeleev parecía prestar particular atención a las propiedades químicas de los elementos, sin embargo cuando llegó el momento de seleccionar su principio rector para la clasificación de los elementos insistió en que el ordenamiento de los elementos por su peso atómico no aceptaría salvedades. Por supuesto, muchos de los predecesores de Mendeleev como De Chancourtois, Newlands, Odling y Lothar Meyer habían reconocido la importancia del peso atómico en el ordenamiento de los elementos en diferentes grados. Pero Mendeleev asimismo alcanzó una comprensión filosófica de los pesos atómicos y de la naturaleza de los elementos que le dejó desplazarse en un territorio desconocido de los elementos todavía extraños. La periodicidad de las propiedades espectroscópicas y químicas de los elementos por medio de la tabla periódica fue un punto de orientación clave en la solución global que elaboró Bohr para el problema de la estructura atómica.
Lo que de ninguna manera quiere decir que el orden de llenado de los orbitales atómicos por los electrones es en algún sentido intrínsecamente irreducible a la física cuántica. Desde esta perspectiva, el peso atómico es visto como una cantidad contingente dependiendo de la abundancia relativa de todos y cada uno de los isótopos de un elemento. La cantidad mucho más fundamental, como ahora la Tabla periódica refiere, es el número atómico de van den Broeck-Moseley, que después fue conciliado, el número de protones en el núcleo. La identidad de un factor es capturada por su número atómico y no por su peso atómico, pues este difiere según la exhibe especial del elemento que ha sido apartado. Si bien, como ahora se mentó, no se tenía un procedimiento para determinar los estados estacionarios de átomos con varios electrones, Bohr infirió de los fantasmas atómicos la oportunidad de prolongar la caracterización de esos estados en la manera en que Sommerfeld caracterizó los estados del hidrógeno. Bohr formuló el problema de la constitución del átomo en concepto de la pregunta ¿De qué manera se puede conformar un átomo mediante la captura y ligadura consecutiva de electrones uno tras otro en el campo de fuerza que rodea al núcleo?
Podía Dividir Una Masa
Leer mas sobre organigrama de una empresa aqui.
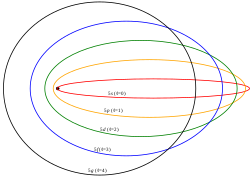
¿Cuál es el modelo atómico más aceptado en la actualidad y porqué?
El modelo átomico aceptado actualmente consiste en un núcleo pesado con carga eléctrica positiva, compuesto por neutrones y protones, rodeado de una nube de electrones con carga eléctrica negativa y masa muy pequeña comparada con la del núcleo. El átomo es eléctricamente neutro.
Este ordenamiento de los bloques de izquierda a derecha no es lo más natural o como podrían aguardarse, ya que en todos y cada capa la distancia desde el núcleo prosigue el orden. Si se cree en la repetición aproximada de las características de los elementos es un hecho objetivo de todo el mundo natural, entonces se adopta una actitud verdadera. O sea lo que invita a los científicos apasionados a probar su talento en el desarrollo de nuevas versiones que de forma frecuente aseguran poseer propiedades superiores que todos y cada uno de los sistemas periódicos antes publicados. En su libro clásico sobre la narración de la Tabla periódica, Edward Mazurs incluye ilustraciones, tal como referencias de cerca de 700 tablas periódicas que han sido publicadas desde la presentada en la década de 1860. En los 40 años que han pasado desde la publicación del libro de Mazurs, han aparecido al menos otras 300 nuevas Tablas periódicas, especialmente si se tienen dentro los Sistemas periódicos publicados en internet.
Leer mas sobre dentistas y ortodoncias en chile aqui.
Algunos como los elementos de las tierras raras con similitudes muy cercanas, propusieron un reto en su predisposición en la Tabla periódica por varios años. Estas fallas plantearon una cuestión filosófica sobre el mérito en los adelantos científicos de las predicciones sobre valores probados. Este es el fenómeno de la vinculación química o combinación química, que difiere claramente de una mezcla física de lo que podría ser azufre en polvo y limaduras de hierro. Pero por algún irreconocible giro histórico, Dalton se negó a aceptar la iniciativa de moléculas diatómicas por el hecho de que él creía firmemente que al presentarse 2 átomos del mismo elemento cualquiera que fuesen deberían repelerse y que consecuentemente no podrían formar una molécula diatómica. La idea del link químico entre 2 átomos de un mismo elemento resultaba novedosa y solamente ciertos lograban familiarizarse con la noción y esto resultó singularmente complicado para Dalton, un vanguardista con una visión tan desarrollada del cómo debían comportarse los átomos.
en que consiste el modelo atomico de sommerfeld
undefined
El próximo miembro, el bromo pertence a los únicos 2 elementos populares que hay como líquidos a temperatura ambiente, siendo el otro el metal mercurio. Moviéndose mucho más apartados hacia abajo, podemos encontrar un elemento sólido, el yodo de coloración violeta-negro. Si a un químico novel se le pidiera agrupar estos elementos por su fachada, resultaría poco probable qué considerara la clasificación conjunta del flúor, cloro, bromo y yodo. Esta es una instancia donde la sutil distinción entre lo perceptible y el sentido abstracto del término de elementos puede ser en especial útil. La similitud entre ellos radica primordialmente en la naturaleza abstracta de los elementos y no en los elementos como substancias que tienen la posibilidad de ser aisladas y observables.
Otros químicos, como Dalton lo hizo por sí solo, descubrieron otra Ley de combinación química, la Ley de las proporciones múltiples. Cuando un factor A se combina con un elemento B, para la formación de sobra de un compuesto, hay una proporción fácil entre la masa de combinación por el elemento B en ambos compuestos. Por servirnos de un ejemplo, carbono y oxígeno se combinan juntos para formar el monóxido de carbono y el dióxido de carbono.
undefined
Einstein y Ehrenfest, en su artículo, se esfuerzan por entender de qué forma los magnetos atómicos aceptan una orientación definida, ya definida, en el campo. En los párrafos siguientes, Einstein y Ehrenfest discuten de forma crítica algunas implicaciones del experimento, más que nada la amenaza al ideal de causalidad, sugiriendo probables explicaciones a los resultados del experimento, pero sin llegar a un esclarecimiento aceptable del problema. También llamado el Modelo atómico cúbico, proponía la estructura de los átomos como un cubo, en cuyos ocho vértices se hallaban los electrones. Fue propuesto por Gilbert N. Lewis y permitió seguir en el estudio de las valencias atómicas y las uniones moleculares, más que nada luego de su actualización por la parte de Irving Langmuir en 1919, construyendo de esta manera el “átomo del octeto cúbico”.
Lea mas sobre imagenes de cumpleaños aqui.
undefined
La explicación de las equivocadas afirmaciones surgió un año más tarde en 1938 por Otto Hahn, Fritz Strassmann y Lise Meitner con el hallazgo de la fisión nuclear. Quedó claro que, en colisión con un neutrón, el núcleo de uranio por ejemplo, podía fraccionar al núcleo generando dos núcleos de tamaño mediano en vez de un núcleo más grande. Por ejemplo, el uranio era capaz de formar cesio y rubidio según la siguiente reacción de fisión. Este fue el primer nuevo elemento conseguido por trasmutación a 18 años del experimento trascendental de Rutherford. Indicios del nuevo elemento tecnecio, después fueron encontrados de modo que existe naturalmente en la tierra en proporciones increíblemente pequeñas.
Principalmente en todos los esfuerzos por progresar la Ley periódica se conserva una misma forma. La representación es una cuestión de convención que pareciera ingresar en conflicto con la noción del realismo que puede ser relativa a los puntos de repetición de las características periódicas presentadas en cualquier Tabla periódica. El formato medio largo generalmente usado en la Tabla periódica, en el primer periodo se integran 2 elementos, mientras que el segundo y el tercero poseen ocho, el cuarto y quinto contienen 18 y así consecutivamente. En estas tablas se encontraban fundamentalmente hacinados todos y cada uno de los entonces elementos conocidos constaban de 8 conjuntos que reflejan el hecho de que, en términos generales, los elementos parecen repetirse en un intervalo de 8 elementos, si estos están en una secuencia natural. Al recabarse mucho más información sobre las propiedades de los elementos y conocer nuevos elementos, apareció un nuevo género de arreglo llamado la Tabla de formato medio largo, este empezó a ganar prominencia y popularidad en la sociedad académica. Mucho más últimamente, aun se han descubierto una exclusiva clase de superconductores de elevada temperatura.