Contenido
errores del modelo atomico de lewis
El documento de Newlands no fue anunciado en las actas de dicha sociedad, si bien si publicó mucho más artículos en varias revistas químicas introduciendo la publicación de subsecuentes Tablas periódicas, defendiendo siempre y en todo momento la Ley de las octavas. En su primer producto sobre la clasificación de los elementos Newlands indicó la siguiente observación sobre el grupo de los metales alcalinos. Otra de las tríadas claves reconocidas por Döbereiner consistió en tres de los elementos halógenos cloro, bromo y yodo.
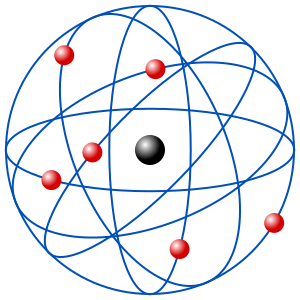
- La principal falla del modelo es enseñar a los electrones como partículas fijas, pero la elección del cubo es una concepción ingeniosa y natural, que refleja visto que la periodicidad química se apoya en intervalos de ocho elementos.
- En un intento de resolver estas disputas, la International Union of Pure and Applied Chemistry dictaminó que los elementos han de ser nombrados ecuánime y de manera sistemática con los numerales del Latín para el número atómico del elemento en cada caso.
Para que el oxígeno complete su órbita, le faltan 2 electrones de valencia, lo que le adjudica mayor seguridad. Los electrones de valencia son los que forman parte en los cambios químicos y tienen la posibilidad de perderse, ganarse o compartirse. ¿Cuántos electrones quedan preparados para conformar enlace con los átomos del mismo o de otro elemento? La regla del octeto te indica que los átomos distribuyen electrones, tal es así que procuran ser más equilibrados con 8 electrones. Son 7, te das cuenta de que se ajusta a las órbitas o los escenarios de energía donde tienen la posibilidad de situarse los electrones, la primera órbita o nivel de energía es la más interna o próxima al núcleo y la séptima la mucho más externa o distanciada del núcleo.
Aprende En El Hogar 3: Ocupaciones Y Respuestas Tercero De Secundaria 6 De Julio
Leer mas sobre evangelio del dia de hoy aqui.
Sus concepciones eran primero que los electrones se comportaban como ondas y segundo que la energía potencial del electrón consistía en la energía por la que era atraído por el núcleo. Schrödinger resolvió su ecuación realizando que los físicos matemáticos continuaran tratando de resolver ecuaciones diferenciales de este tipo aplicando condiciones particulares. Los intentos de defender este orden de llenado solían estar unidos a la interpretación y lo que pretendía ser explicado. Sabemos que los periodos se cierran porque los gases nobles generan elementos con disposición de electrones de la forma 2, 10, 18, 36, 54, etc. De la misma forma se tenía conocimiento del orden de llenado de orbitales acorde las visualizaciones pero no englobado en una teoría estructurada.
Incluían la emanación llamada torio, Uranio-X y Gd2 y muchas otras nuevas especies. Algunas de las ImagLec3 de rayos X de Röntgen se enviaron a Paris, donde llegaron a Henri Becquerel quien se interesó por examinar la relación entre los rayos X y la propiedad de fosforescencia, por la que ciertas substancias emiten luz al exponerse al sol. Para evaluar esta iniciativa Becquerel envolvió ciertos cristales de una sal de uranio en un papel grueso y para omitir los fotones del sol, guardó estos materiales en un cajón por algunos días. Por un posible golpe de suerte Becquerel puso sus cristales envueltos sobre una placa fotográfica sin desenrollar antes de cerrar el cajón.
Con este modelo, en este link covalente se distribuyen 2 pares de electrones de valencia, es decir una cara de los cubos y los dos completan sus 8 electrones. Este caso de ejemplo se puede emplear para representar la unión de la molécula de oxígeno. Los átomos de los gases nobles son equilibrados debido a que su cubierta mucho más externa está completa. Cabe señalar que el helio tiene su capa completa, por el hecho de que al hallarse en el primer periodo de tiempo tiene el número máximo de electrones que son 2. No obstante, no cumple con la regla del octeto, ya que está relata que deben completarse ocho electrones en la capa de valencia. BORO. El átomo de este elemento tiene 3 electrones de valencia ¿cuántos electrones tienes que poner en el modelo cubico que lo representa?
errores del modelo atomico de lewis
undefined
Entre los elementos, no obstante, no solo durante un periodo de tiempo cambian las propiedades físicas y químicas, sino la periodicidad no es exacta. Los elementos en cualquier conjunto de la Tabla periódica no son repeticiones precisas en cada uno de ellos. En este sentido su periodicidad no es precisa a diferencia de la escala musical, donde uno vuelve a una nota por exactamente la misma letra, que suena como la nota original pero terminantemente no es idéntico a la que es una octava más alta.
La utilización moderno de los símbolos que representan a los elementos fue introducido por el químico Jöns Jacob Berzelius en 1813. Un árbol de la vida siempre y en todo momento es una manera de desear buena suerte, es una forma de recordar que no serías lo que eres si no hubieras sido diferente antes. Pero la idea es que realices el tuyo de una manera importante, utilizando elementos de las artes y pensando en los árboles de la vida que hacen en Metepec, por ejemplo. Después, se registra en la tabla las especificaciones del cuerpo geométrico que se forma. El modelo de par electrónico deja detectar cómo se forma el link covalente.
undefined
Leer mas sobre horario de misas en mexico aqui.
Desde 1997, han sido publicadas múltiples demandas para la síntesis de los elementos del 113 al 118. Esta situación se comprende ya que los núcleos con un número impar de protones son invariablemente mucho más inestables que aquellos con un número par de protones. Esta disparidad de seguridad se genera porque tanto protones como electrones tienen un spin medio y en el caso de los electrones acceden a los orbitales de energía de dos en 2, con spin opuestos. Esta determinación se hace sobre la base uno para cada átomo separado y no mediante una solución universal de uno aplicable a todos los átomos de los elementos.
undefined
Lea mas sobre equipo de proteccion personal aqui.
También debes tomar en cuenta que para ejercer tu independencia precisas respetar los derechos del resto personas, asumiendo la responsabilidad de tus actos, esto es, comprometido ante las consecuencias que surjan de tus resoluciones tomadas. De la manera en que actúes no debes olvidar que la independencia tiene límites; y que debes ser consciente de lo que debes y no tienes que llevar a cabo para conducirte de forma ética, siguiendo tu método de forma independiente y autónoma, sin dañar la integridad de los demás. Aparte de la esclavitud, hay otros elementos que se deben considerar para entender qué es la independencia y tienen que ver con el reconocimiento al derecho natural de los seres humanos a ser tratados con dignidad.