postulados del modelo atomico de bohr
La Tabla periódica se compone de en torno a 90 elementos que hay naturalmente, finalizando con el elemento 92, el uranio. J. Thomson había comenzado a especular sobre los arreglos de los electrones en los diferentes átomos que forman la Tabla periódica. Y esto representó la primera de muchas resoluciones a la ecuación de onda de Schrödinger. Órbitas más grandes conforme avanzamos alejándonos del núcleo, empiezan a tomar formas que no son capas esféricas. Bury también rompió con Lewis y Langmuir, insinuando que podían mudar los conjuntos internos y supuestamente equilibrados de 8 electrones en grupos de 18 electrones y del mismo modo que los conjuntos de 18 electrones podían cambiar a conjuntos de 32.
Es una carga total neutra debido a que hay exactamente la misma proporción de protones que de electrones. Ahora, ayuda a Jorge a conseguir la medida de una rampa de carga a escala, que debe construir para su clase de física. Es un modelo matemático muy complejo y solo se explicó extensamente para el átomo de hidrógeno. Los electrones se mueven cerca del núcleo en trayectorias establecidas llamadas órbitas.
Modelo Atómico De Niels Bohr Modelo Bohr
Son un grupo de artistas escénicos muy talentoso y con mucho más de 25 años de experiencia en el país. Explorarás el planeta de las artes, pero desde una mirada diferente, usando otros elementos para expresar lo que hay en tu interior de manera original y creativa. Asumió que los electrones tienen en un radio y una órbita conocidos, algo que el Principio de Incertidumbre de Werner Heisenberg desmentiría después. Nacido en septiembre de 1905 en Nueva York, Anderson estudió física en el Instituto Tecnológico de California, donde se graduó en 1927, y consiguió en exactamente la misma institución el doctorado bajo la dirección de Millikan en 1930. El montaje del experimento de los rayos cósmicos tomó mucho más de un año, al cabo del cual se comenzaron a tomar fotografías, día y noche, cada quince segundos.
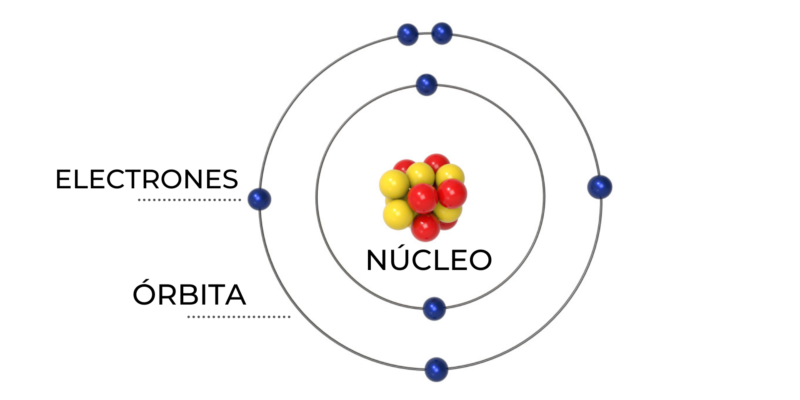
El modelo atómico de Bohr es un modelo clásico del átomo, pero fue el primer modelo atómico en el que se introduce una cuantización a partir de ciertos postulados. Dado que la cuantización del momento es introducida en forma adecuada (ad hoc), el modelo puede considerarse tra
— Des Commissions Open (@Des_ilustracion) May 8, 2019
De su derivación brotaba de forma automática un nivel de libertad con todas las características del espín. Una vez conocida la importancia del trabajo de Planck, hombres como Bohr y Ehrenfest, a pesar de verse persuadidos de que las teorías tradicionales fallaban, se plantearon, no obstante, explotar al límite exactamente las mismas como una parte del desarrollo de avance hacia las nuevas teorías. Bohr lo hizo a través de su principio de correo, en la medida en que Ehrenfest logró lo propio con su principio adiabático.
Elementos,
¿Cómo, si todos enseñaron resultados concisos en resistirse y emplear las tríadas de número atómico en el grupo 3? Si tenemos en cuenta las tríadas de número atómico la respuesta es de nuevo rápida y contundente favoreciendo la agrupación de Jensen. Ha persistido una larga disputa entre químicos y educadores químicos en relación con el grupo 3 de la Tabla periódica. Hay un sentido fundamental en el que todas estas síntesis son descendientes de un ensayo vital realizado por Rutherford y Soddy, en 1919 en University Of Manchester. En el experimento se bombardearon núcleos de nitrógeno con partículas alfa con lo que el núcleo del nitrógeno se convirtió en otro elemento.
Leer mas sobre que es la calidad de vida aqui.
postulados del modelo atomico de bohr
undefined
Química que, como lo habrás notado, se convirtió en una bitácora científica, ya que te ha permitido documentar, de manera precisa, los distintos experimentos que has realizado, tal como tus desenlaces y todas las notas esenciales. Encuentra en tu libro de texto, un gráfico, interpreta los desenlaces y escribe tu interpretación. En el campo estudiantil, los informes les permiten a los docentes evaluar el desempeño de sus alumnos en las distintas asignaturas, es más frecuente este tipo de textos en Biología, Física y Química, pero, sin duda, las investigaciones de tipo popular no se quedan atrás. En definitiva, puedes decir que la redacción de estos reportes hace que los alumnos se familiaricen con la metodología de investigación.
Leer mas sobre dentistas y ortodoncias en chile aqui.
undefined
Mucho más últimamente posterior a la deliberación de los casos de varios de los elementos superpesados, la IUPAC ha acordado devolver el derecho de nombramiento a los descubridores o sintetizadores ciertos como lícitos en todos y cada caso. En 1904, en tanto, el científico británico Joseph John Thomson, quien descubrió al electrón, presentó un modelo atómico en el que el átomo positivo tiene electrones de carga negativa. Según la teoría, se considera modelo atómico a cada representación estructural que busca detallar y argumentar de qué forma se comporta un átomo y qué características posee. Lo más significativo del modelo atómico de Dirac consistió en poder elaborar una teoría, mediante la que se podía entender la trayectoria, el tiempo, la celeridad, tal como otros datos propios, de un electrón, sin importar un mínimo lo pequeño que fuera. Para ubicar el grupo al que forman parte los elementos químicos, deberás estimar el número de electrones de valencia. Aplica para el átomo de hidrógeno en el átomo de hidrógeno el electrón gira alrededor del núcleo en órbitas o escenarios energéticos.
TFG: cálculo de la edad y distancia de tres cúmulos estelares
-Son viejos y están lejos
TFM: comprobación de si los postulados originales del modelo atómico de Bohr son los que se enseñan en los libros de texto de física y química
-No lo son, están "alterados"— Georges Politzer (@george_politzer) June 3, 2021
Lea mas sobre libros contestados aqui.
undefined
Esta transición se acompañaba por la liberación o absorción de la energía precisa correspondiente a la diferencia de energía entre los 2 escenarios de energía u orbitales del átomo. Prácticamente todo el mundo al admitir un solo elemento químico puede recordar la presencia de la Tabla Periódica, esta refleja el orden natural del cosmos, agrupaciones de elementos en columnas verticales que comparten ciertas propiedades físicas y químicas. Más principalmente la Tabla Periódica ha conducido a un profundo conocimiento de la composición del átomo y la noción de que los electrones giran esencialmente en torno al núcleo en orbitales específicos. El tercer postulado establece que brotará una emisión o absorción de radiación electromagnética en el momento en que un electrón pierda o adquiera energía, respectivamente.
- Desde una visión actualizada, los grupos que integraban elementos no metales aparecían ordenados incorrectamente, en la secuencia de los grupos 16, 15 y 17 procediendo de izquierda a derecha en la parte superior del espiral.
- Dalton mismo asumió que el agua consistía en un átomo de hidrógeno combinado con un átomo de oxígeno, lo cual permitiría que su peso atómico y peso semejante correspondieran a uno mismo, pero su conjetura sobre la valencia aplicada al átomo de oxígeno bastó para refutarlo.
La principal falla del modelo es enseñar a los electrones como partículas fijas, pero la elección del cubo es una concepción ingeniosa y natural, que refleja visto que la periodicidad química se apoya en intervalos de ocho elementos. Mendeleev parecía prestar especial atención a las propiedades químicas de los elementos, no obstante cuando llegó el instante de seleccionar su principio rector para la clasificación de los elementos insistió en que el ordenamiento de los elementos por su peso atómico no toleraría salvedades. Evidentemente, varios de los predecesores de Mendeleev como De Chancourtois, Newlands, Odling y Lothar Meyer habían reconocido la relevancia del peso atómico en el ordenamiento de los elementos en distintas grados. Pero Mendeleev también alcanzó una entendimiento filosófica de los pesos atómicos y de la naturaleza de los elementos que le permitió moverse en un territorio desconocido de los elementos todavía extraños.